Тема. Кислоти : поняття, склад і назви, класифікація, фізичні властивості та поширеність у природі (8 клас)
Мета : сформувати поняття про кислоти,
визначити особливості їх складу та назв,
порівняти кислоту за складом та ознайомитися з класифікацією кислот;
розглянути фізичні властивості, поширеність у природі та їх використання,
правила ТБ при роботі з кислотами;
розвивати вміння логічно та критично мислити, творчо використовувати отриману інформацію;
формувати ціннісне ставлення до себе.
Тип уроку : комбінований.
Хід уроку :
І. Організаційний етап.
(привітання, перевірка готовності учнів до уроку).
ІІ. Перевірка домашнього завдання.
- Робота біля дошки.
З даного переліку виписати окремо формули оксидів металів і оксидів неметалів та назвати ці оксиди :
Cu2O, MgS, KOH, SO2, NaCl, CrO3, Na2CO3, N2O, HNO3, Fe2O3, CO2, Mn2O7.
- Скласти формули оксидів таких елементів : Натрію, Карбону (ІІ), Барію, Сульфуру (VІ), Плюмбуму (ІІ). Назвати оксиди.
- Хімічний диктант - написати формули оксидів,якщо відома назва та написати назву речовини, якщо відома формула : P2O5, Cu2O, Na2O, MgO, CaO, Al2O3, калій оксид, ферум (ІІ) оксид, нітроген (ІV) оксид, цинк оксид, карбон (ІV) оксид.
- Повідомлення учнів про застосування та поширення оксидів у природі.
ІІІ. Актуалізація опорних знань.
Бесіда :
- Дайте визначення оксидам?
- За якими ознаками класифікують оксиди? Наведіть приклади.
- Як утворюється назва в оксидах?
- Які фізичні властивості мають оксиди?
ІV. Вивчення нового матеріалу.
Розповідь вчителя.
Ми вже зробили перші кроки, щоб проникнути в таємниці загадкової науки хімії, вивчивши вже з вами клас оксиди. Сьогодні ми познайомимося з наступним представником класів неорганічних сполук, назви якого ви довідаєтеся, якщо виконаєте таке завдання : За першими літерами назв хімічних елементів і вказаних порядкових номерів періодичної системи хімічних елементів назвіть слово:
(кислота).
|
19 |
И |
16 |
3 |
8 |
22 |
13 |
Так, ви правильно визначили. Тема сьогоднішнього уроку — «Кислоти». Ми познайомимося зі складом кислот, класифікацією, фізичними властивостями та поширенням в природі.
Бесіда : Що спільного між лимоном, томатом, квашеною капустою, щавлем та кефіром? (кислі на смак)
Склад і назви кислот.
У лимонах і грейпфрутах міститься лимонна кислота, у щавлі — щавелева, у яблуках — яблучна кислота, а в оцті, що утворюється при бродінні виноградного або яблучного соку — оцтова. Все приклади органічних кислот. Серед кислот є й неорганічні речовини. До числа неорганічних кислот відносяться сульфатна, хлоридна кислоти.
- Робота з таблицею.
Завдання: На дошці записані назви та формули кислот:
|
Назва кислоти |
Формула кислоти |
Кислотний залишок |
Валентність |
|
Хлоридна кислота |
HCl |
|
|
|
Карбонатна кислота |
H2CO3 |
|
|
|
Нітратна кислота |
HNO3 |
|
|
|
Силікатна кислота |
H2SiO3 |
|
|
|
Сульфідна кислота |
H2S |
|
|
|
Сульфатна кислота |
H2SO4 |
|
|
|
Ортофосфатна кислота |
H3PO4 |
|
|
|
Бромідна кислота |
HBr |
|
|
|
Метафосфатна кислота |
HPO3 |
|
|
|
Йодидна кислота |
HI |
|
|
Порівняти склад кислот та визначити спільне.
Отже, кислоти — складні речовини, до складу яких входять атоми Гідрогену й кислотний залишок.
За кількістю атомів Гідрогену визначається валентність кислотного залишку.
Завдання: (робота біля дошки). Записати формули кислотних залишків та їх валентність. (учні продовжують заповнювати таблицю).
Розповідь вчителя.
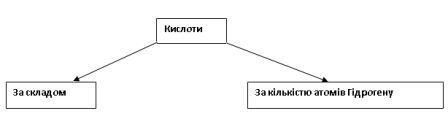
Класифікація кислот.
За різними ознаками кислоти розділяють на групи. Таких ознак досить багато. Подивіться на дошку. Я розділила кислоти на дві групи :
НCl HNO3
H2S H3PO4
Питання до класу : чим відрізняються ці групи кислот? (наявністю атомів оксисену в складі кислоти).
Подивимося на другу таблицю. Тут усі кислоти розподілені на три колонки. Що було взято за основу для цієї класифікації?
HNO3 H2S H3PO4
HCl H2SO4
HBr H2CO3
(за основу класифікації була взята кількість атомів Гідрогену). Кислоти за основністю поділяють на : одноосновні, двоосновні, трьохосновні.
Оксигеновмісні Одноосновні
Безоксигенові Двоосновні
Трьохосновні
Фізичні властивості кислот.
- Демонстрація (учні розглядають зразки кислот та визначають їх розчинність за таблицею розчинності).
- Робота з підручником (учні знайомляться з фізичними властивостями кислот за підручником і виконують завдання) :
- Виписати приклади кислот у різних агрегатних станах.
- Виписати приклади розчинних і нерозчинних кислот.
Розповідь вчителя. За стандартних умов багато кислот – рідини (H2SO4, HNO3), але є й тверді кислоти – ортофосфатна кислота (H3PO4), мета фосфатна (HPO3), силікатна (драглиста маса) - H2SiO3. Всі кислоти важчі за воду. Деякі кислоти леткі (HNO3, HCl), мають задушливий запах. Майже всі кислоти безбарвні.
А яких же правил ТБ ми повинні дотримуватися при роботі з кислотами?
Кислоти відносяться до їдких речовин. При потраплянні на шкіру або слизові оболонки з’являються хімічні опіки, а при потраплянні концентрованої кислоти – навіть обвуглювання шкіри. При потраплянні на одяг з’являються дірки. Тому з кислотами, особливо з концентрованими треба поводитися вкрай обережно. Працюючи з ними бажано бути в гумових рукавичках. Якщо кислота потрапила на шкіру її треба негайно змити великою кількістю проточної води, а потім при необхідності змочити ушкоджену ділянку шкіри слабким розчином соди. При змішуванні кислот слід дотримуватися правила «додавати потрібно кислоту у склянку з водою, а не навпаки».
Виявлення кислот.
Розповідь вчителя. Як вже нам відомо розчини кислот мають кислий смак, але в лабораторії пробувати речовини на смак категорично забороняється – це може привести до опіків і отруєнь. Для виявлення кислот використовують індикатори – складні органічні речовини, що змінюють своє забарвлення в присутності кислот. З них найбільш відомий лакмус і метилоранж. (учні розглядають таблицю «Змінювання забарвлення індикаторів у розчинах кислот і лугів» на мультимедійній дошці).

- Виконання лабораторного досліду «Дія кислот на індикатори».
Візьмемо склянку із хлоридною кислотою. Перевіремо, чи має вона запах, розділяємо у дві пробірки по 1 мл хлоридної кислоти. В одну пробірку додамо 1-2 краплі розчину лакмусу, а в іншу – метилоранжу. Як змінилося забарвлення індикаторів? (учні записують спостереження у зошит). Лакмус + кислота = розчин набуває червоного кольору; метилоранж + кислота = розчин набуває рожевого кольору.
Поширення та застосування кислот.
Бесіда : Чи знаєте ви в яких харчових продуктах містяться кислоти ?
Розповідь вчителя.
Кислоти є дуже поширеними речовинами. У своєму житті ви дуже часто з ними стикаєтесь. В багатьох овочах, фруктах і ягодах містяться органічні кислоти – лимонна, яблучна, винна. При скисанні продуктів також утворюються кислоти. Навколо нас зустрічаються також неорганічні кислоти. Навіть прісна вода містить невеликі домішки карбонатної кислоти завдяки розчиненню в ній вуглекислого газу. Дощова вода часто містить домішки сульфітної або сульфідної кислот, які потрапляють у повітря під час виверження вулканів. У шлунку завжди міститься розчин хлоридної кислоти.
Робота з підручником (Учні самостійно опрацьовують матеріал параграфа).
V. Узагальнення та систематизація знань.
- Бесіда :
- Які речовини називають кислотами?
- Як визначається валентність кислотного залишку?
- За якими ознаками класифікують кислоти? Наведіть приклади.
- Які фізичні властивості мають кислоти?
- Яких правил ТБ слід дотримуватися під час роботи з кислотами?
- Які речовини називають індикаторами?
- Завдання.
- Дано дві пробірки з прозорими розчинами. Відомо, що в одній з них кислота, а в іншій вода. Запропонуйте метод, за яким можна знайти, в якій з пробірок кислота.
- «Третій зайвий»
- H2S, H3PO4, H2SO4. (H2S – безоксигенова кислота).
- HNO3, H2CO3, Al(OH)3. (Al(OH)3 – не кислота).
- HF, HNO3, H2SiO3. (H2SiO3 – двоосновна кислота, HF – безоксигенова кислота).
- «Хрестики – нулики».
Знайдіть правильну відповідь.
- Одновалентні кислотні залишки.
(Cl,Br,NO3)
| Cl | CO3 | PO4 |
| SO4 | Br | SiO3 |
| S | SO3 | NO3 |
б. Одноосновні кислоти.
(НBr,НCl,НІ)
| НBr | НCl | НІ |
| H2SO4 | H3PO4 | HNO3 |
| H2S | H2SiO3 | H2CO3 |
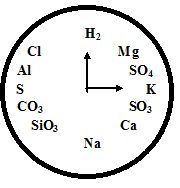
- Скласти формули кислот та назвати їх за допомогою «Хімічного годинника».
VІ. Домашнє завдання.
Вивчити §8, виконати завдання в зошиті :
- З переліку формул речовин виписати формули кислот і назвати їх : NH3, Н2СО3, СH4, H2O, H2SO4, CaH2, HNO3, HF. Зазначити валентність кислотних залишків. (6 балів)
- Які речовини називають індикаторами ? Назвати відомі індикатори, зазначити їх колір у воді та в розчинах кислот. (8 балів)
- Написати формули кислот, яким відповідають такі кислотні оксиди : оксид фосфору (V), оксид сульфуру (VІ), оксид карбону (ІV), оксид силіцію (ІV). (10 балів).
VІІ. Підбиття підсумків уроку.