Тема : Класифікація неорганічних речовин. Оксиди : поняття, склад і назви, будова і фізичні властивості, поширеність у природі (8 клас)
Мета : повторити знання учнів про класифікацію простих речовин із курсу 7 класу;
дати поняття про класи складних речовин, зокрема з’ясувати склад, будову та фізичні властивості оксидів;
удосконалити вміння учнів складати формули бінарних сполук на прикладі оксидів та утворювати їх назви за сучасною українською номенклатурою;
розглянути поширеність оксидів у природі;
розвивати вміння аналізувати та систематизувати інформацію;
формувати ціннісне ставлення до себе.
Тип уроку : вивчення нового матеріалу.
Хід уроку :
І. Організаційний етап.
(привітання, перевірка готовності учнів до уроку)
ІІ. Актуалізація опорних знань.
1. Розповідь вчителя.
У повсякденному житті ми з вами зустрічаємося з безліччю різних речовин. Всі ці речовини мають хімічну природу, але різні за будовою та властивостями. Учені систематизували та класифікували знання про різні речовини, а як саме вони класифіковані ми з вами розглянемо в темі «Основні класи неорганічних сполук». На сьогоднішньому уроці ми познайомимося з класифікацією та одним із класів – «Оксиди».
(зачитується тема, мета та цілі уроку)
Оксиди, відомо, - бінарні сполуки :
В них два елемента взялися за руки,
Їх міцно зв’язали хімічні зв’язки.
У парі в реакцію йдуть залюбки.
Їм різні властивості дарує природа :
Вони полюбляють в реакції воду,
Утворюють солі, основи, кислоти,
Їх треба вивчати !
Отож до роботи!
Роботу почнемо всі ми негайно!
Оксидам формулу створимо загальну :ЕхОу !
2. Виконання вправ.
Завдання :
- «Спробуймо пригадати».
Складіть формули оксидів за валентністю елементів
(учень заповнює таблицю, записану на дошці.)
Формули оксидів :
| Символи елементів | Н | Мg | P(v) | Zn | Fe (ІІІ) |
| О |
Бесіда : щоб скласти хімічну формулу сполуки ви використовували поняття «валентність». А що ж таке валентність? Та як ви розумієте поняття «хімічна формула»?
- «Спробуймо розпізнати серед запропонованих формул оксиди».
(схема зображена на мультимедійній дошці.)
Закресліть однією лінією три формули оксидів по горизонталі, по вертикалі або по діагоналі :
| Fe | Zn | H2O |
| Cu2O | SO2 | MgO |
| NaCl | Mg | Fe2O3 |
б.
| Al2O3 | ZnO | O2 |
| Al(OH)3 | P2O3 | H2SO4 |
| H2S | N2O5 | CaO |
ІІІ. Мотивація навчальної діяльності.
Розповідь вчителя.
У 7-му класі ви одержали знання про оксиди як бінарні сполуки. Сьогодні на уроці ми поглибимо ці знання, розглянувши місце оксидів у класифікації складних неорганічних сполук, їх склад, поширення у природі та назви за сучасною українською номенклатурою.
ІV. Вивчення нового матеріалу.
Ви вже ознайомилися з поділом речовин на неорганічні та органічні. Вам відомо, що неорганічні поділяються на прості і складні речовини.
Бесіда : Які речовини називають простими, а які складними?
Щоб закінчити повну класифікацію речовин, попрацюйте з підручником і допишіть у зошити схему.
(робота з підручником).
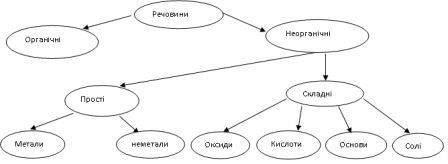
Сьогодні ми детально вивчатимемо клас оксидів.
Оксиди – це складні речовини, до складу яких входять два елементи, одним з яких є Оксиген. Загальна формула оксидів : ЕхОу.
Розповідь вчителя.
Усі оксиди об’єднуються в один клас – групу речовин із подібним складом і будовою. Але навіть у межах одного класу оксиди мають різні властивості.
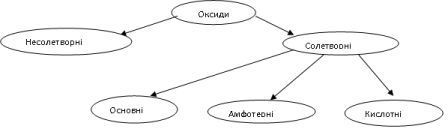
Оксиди, яким відповідають основи (незалежно від того, реагують з водою чи ні) називаються основними.
Оксиди, яким відповідають кислоти (незалежно від того, реагують з водою чи ні) називаються кислотними.
Оксиди, які здатні виявляти кислотні або основні властивості залежно від природи сполуки, з якою вона взаємодіє, називаються амфотерними.
Зі складом і класифікацією ми ознайомилися. А які були в них назви? Як називають їх тепер? Виходячи з назви оксиду досить легко скласти його хімічну формулу. Для цього використовують певний алгоритм.
- Записуємо символи елементів і надписуємо їх валентність (символ Оксигену завжди пишеться на другому місці) :
V ІІ ІІІ ІІ
PO; AlO.
- Обчислюємо найменше спільне кратне для значень валентностей елементів : V і ІІ = 10; ІІІ і ІІ = 6.
- Число атомів елемента дорівнює відношенню найменшого спільного кратного до його валентності – 10 : V = 2 (Р), 10 : ІІ = 5 (О); 6 : ІІІ = 2 (Аl), 6: ІІ = 3 (О).
- Записуємо індекси після символів елементів :
V ІІ ІІІ ІІ
P2O5; Al2O3.
Пояснення вчителя.
Отже, кожен оксид має тривіальну назву і назву за сучасною номенклатурою, остання з яких складається із назви елемента, його валентності, якщо вона змінна (римська цифра в дужках) і слова «Оксид», наприклад :
- Вуглекислий газ – СО2 – карбон (ІV) оксид.
- Негашене вапно – СаО – кальцій оксид.
Робота з підручником.
Учні ознайомлюються в підручнику з таблицею «Назви оксидів» та фізичними властивостями оксидів.
Демонстрація.
Розглядають зразки оксидів, які зображено на мультимедійній дошці та в роздатковій колекції «Оксиди» на партах.
(занотовують відомості про фізичні властивості оксидів у зошити).

Поширеність оксидів у природі та їх використання
Оксиди є досить поширеними у природі сполуками. В природі існує близько трьохсот оксидів. Вони зустрічаються : у літосфері, атмосфері, гідросфері, (SiO2 – силіцій (ІV) оксид, Fe2O3 –ферум (ІІІ) оксид, СО2 – карбон (ІV) оксид).
Бесіда : як ви вважаєте, який оксид є найпоширенішим в природі ? Найпоширенішим оксидом є вода (Н2О). Гідроген оксид – вода – завжди присутня у повітрі в газуватому стані, з’являється завдяки випаровуванню води з різноманітних водоймищ та після дощів. Вода в повітрі обумовлює вологість повітря, і коли її кількість велика для даної температури, газувата вода перетворюється на рідку і випадає у вигляді роси або дощу. Велике значення вода має в житті людини, рослин і тварин. Її широко використовують у побуті та промисловості. Саме про воду складено багато загадок, приказок, віршів, прислів’їв, висловів. Наприклад :
- «Воді була дана чудодійна влада – стати соком життя на землі». (Леонардо да Вінчі).
- «Життя – це особлива колоїдна водна система, особливе царство природних вод». (В.І.Вернадський).
Багато оксидів є шкідливими, наприклад :
- Нітроген (ІV) оксид - (NO2) – отруйний, його ще називають «лисячий хвіст» через забарвлення. Часто він додає кольору диму, що виділяється з труб на металургійному виробництві.
- Карбон (ІІ) оксид - (СО) – дуже отруйний. Утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з’являються сильний головний біль, нудота, вона може знепритомніти і навіть померти!
Робота з підручником (учні самостійно ознайомлюються з властивостями деяких оксидів).
V. Закріплення та узагальнення знань.
Завдання :
1. Складіть рівняння реакцій сполучення між простими речовинами, під час яких утворюються оксиди : CO2, Al2O3, MgO, P2O5, Na2O.
- Скласти формули оксидів та дати назву оксидам.
- У якому з оксидів Феруму – ферум (ІІІ) оксиді – Fe2O3 чи ферум (ІІ) оксиді – FeO – більше Оксигену?
VІ. Домашнє завдання.
Вивчити § 5,6; виконати завдання1-4 (ст. 40), підготувати короткі повідомлення на теми «Застосування та поширення оксидів у природі».
VІІ. Підбиття підсумків уроку.