Тема: Основи: поняття, склад і назви, класифікація, виявлення, використання. (8 клас)
Мета: сформувати поняття про основи, визначити особливості їх складу та назв;
розглянути фізичні властивості основ і ознайомитися з класифікацією основ по їх розчинності;
сформувати вміння складати формули основ, давати їм назви та вміння виявити луги за допомогою індикаторів;
розглянути використання основ та правила техніки безпеки під час роботи з основами;
розвивати вміння творчо використовувати отриману інформацію;
формувати ціннісне ставлення до себе.
Тип уроку: вивчення нового матеріалу.
Хід уроку.
І. Організаційний етап.
(привітання, перевірка готовності учнів до уроку).
ІІ. Перевірка домашнього завдання.
Робота з картками.
- З даного переліку виписати окремо формули оксидів: CO2, H2O, CuS, MnO2, NaOH, K2O, Mn2O7, N2O5, Fe(OH)3, Na2SO4. (5 балів)
- Скласти формули кислот за кислотними залишками (умовна валентність зазначена): SO3 (II), SO4 (II), PO4 (III), SiO3 (II), Br (I), S (II), F (I). Дати назву відповідним кислотам. (7 балів)
- Скласти формули і назвати оксиди таких елементів: Нітрогену (І), Кальцію, Калію, Фосфору (V), Сульфуру (IV), Магнію, Карбону (IV). (9 балів)
- Обчислити масову частку Сульфуру в сульфур (VІ) оксиді. (11 балів)
ІІІ. Актуалізація опорних знань.
Бесіда:
- Назвіть основні класи неорганічних сполук.
- Які елементи – металічні чи неметалічні – входять до складу кислот?
- Що таке індикатори?
- Яких правил безпеки слід дотримуватись при роботі з кислотами і чому?
Мотивація.
Кислоти входять до складу деяких миючих засобів. Але є миючі засоби (наприклад, для чищення поверхні кухонних плит), до складу яких входять не менш небезпечні їдкі речовини, ніж кислоти. На етикетках таких засобів написано, що до складу входять, наприклад, їдкий натр, їдке калі. Ці речовини є протилежними за своїми властивостями до кислот.
Як ви думаєте, до якого класу неорганічних сполук вони можуть належати? (основи).
Отже, тема сьогоднішнього уроку «Основи, їх будова, класифікація та використання». (разом з учнями формулюються питання, які слід розглянути на уроці).
IV. Вивчення нового матеріалу.
Розповідь вчителя.
Як я вже говорила, основи є хімічними протилежностями кислот. Вони також складають досить великий клас сполук. Неорганічні основи ще називають гідроксидами, тому що вони складаються з двох частин: атомів металічних елементів і гідроксильної групи – ОН. Наприклад, КОН, Mg(OH)2, Al(OH)3.
Основи — складні речовини, що складаються з атома металічного елемента і однієї або декількох гідроксигруп ОН.
Гідроксигрупа є одновалентною, тому число гідроксигруп у складі основи дорівнює валентності металічного елемента. Назви гідроксидамдавати досить просто: назва складається з двох слів: перше – назва металічного елемента, а друге – слово «гідроксид».
Якщо металічний елемент може виявити декілька валентностей, то в назві також вказується його валентність римськими цифрами в дужках.
Наприклад:
|
I |
|
|
|
КОН |
— |
Натрій гідроксид |
|
II |
|
|
|
Mg(OH)2 |
— |
Магній гідроксид |
Завдання.
(на дошці зображені формули гідроксидів, дати їм назву): Cu(OH)2, Zn(OH)2, NaOH, Fe(OH)3, Al(OH)3, Ba(OH)2.
Класифікація та фізичні властивості основ.
Основи поділяються на розчинні та нерозчинні у воді (робота з таблицею розчинності). Розчинні основи називають лугами.
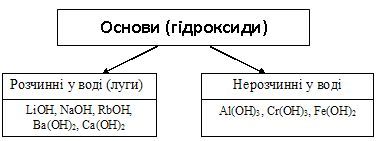
За стандартних умов усі луги – тверді речовини білого кольору, добре розчинні у воді. NaOH і KOH — милкі на дотик, дуже їдкі.
На відміну від всіх лугів, кальцій гідроксид (гашене вапно) малорозчинний у воді. Його насичений розчин називають вапняною водою, а суспензію у воді — вапняним молоком.
Нерозчинні гідроксиди — тверді речовини різного забарвлення, без запаху, у воді не розчиняються. Наприклад: Купрум (ІІ) гідроксид Cu(OH)2 — має блакитний із зеленкуватим відтінком колір, ферум (ІІІ) гідроксид Fe(OH)3 — бурий, а Fe(OH)2 — блідо-зеленкуватий, майже білий.
При роботі з лугами потрібно поводитись обережно, оскільки вони роз’їдають шкіру, деревину, папір, спричиняють серйозні опіки шкіри. Якщо розчин лугу все ж таки потрапив на шкіру, необхідно відразу ж змити його великою кількістю води, аж доки щезне відчуття милкості, а потім нейтралізувати розчином борної кислоти — Н3ВО3.
Виявлення основ.
Так само як і кислоти, луги можна виявити у водних розчинах за допомогою індикаторів. У присутності лугу лакмус забарвлюється в синій колір, а метилоранж — у жовтий. Кращим індикатором на луги є фенолфталеїн — у нейтральному середовищі і кислотному середовищі він безбарвний, а в присутності лугу здобуває яскраве малинове забарвлення. Але нерозчинні гідроксиди забарвлення індикаторів не змінюють.
(робота з таблицею «Забарвлення індикаторів у розчинах кислот і лугів»)
Для підтвердження даних слів на практиці виконаємо лабораторний дослід «Дія розчину лугу на індикатори».
(учні розглядають у пробірках зразки гідроксидів натрію і кальцію).
Завдання: Долити до кожної пробірки по 3 мл води і обережно перемішати. Що спостерігається? Розділити вміст кожної пробірки на три частини. До однієї з них додайте 2-3 краплі розчину лакмусу, до двох інших — метилоранжу і фенолфталеїну. Яке забарвлення мають індикатори?
(учні записують спостереження та висновки в зошит).
Лакмус + луг = розчин набуде синього кольору;
Метилоранж + луг = розчин набуде жовтого кольору;
Фенолфталеїн + луг = розчин набуде малинового кольору.
Використання основ.
Розповідь вчителя. На практиці здебільшого використовуються тільки луги, в першу чергу натрій гідроксид та кальцій гідроксид. Кальцій гідроксид «гашене вапно» — використовується у будівництві як будівельний матеріал. Натрій гідроксид використовується при виробництві мила, миючих засобів, ліків, у шкіряній промисловості, для очищення нафти.
V. Закріплення та узагальнення знань.
Завдання: 1. Дати назви речовинам, які зображені в пелюстках ромашки.
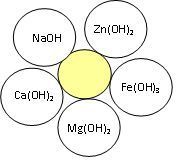
- Скласти формули основ та назвати їх.
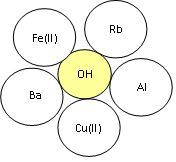
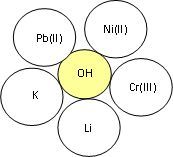
3. «Третій зайвий».
- (знайти ряд, в якому тільки основи)
а). NaOH, KOH, Al(OH)3 б). HCl, Zn(OH)2, Cr2O3
в). CuO, Ba(OH)2, Fe(OH)2
г). Ca(OH)2, KOH, Mg(OH)2
- (знайти «зайву» речовину)
а). NaCl, RbOH, Cu(OH)2
б). LiOH, Cr(OH)3, H2SO4
4. Дано дві пробірки з прозорими розчинами. Відомо, що в одній з них кислота, а в іншій – луг. Як можна визначити вміст пробірок?
5. Обчісліть кількість речовини гідроксиду калію, якщо маса речовини становить 20 г.
6. Обчисліть масу речовини, яку має порція барій (ІІ) гідроксиду кількістю речовини 0,3 моль.
VІ. Домашнє завдання.
Вивчити § 11, виконати завдання 6 – 7 (ст 71).
VІІ. Підбиття підсумку уроку.